Diferenças entre edições de "PV"
| Linha 1: | Linha 1: | ||
| − | =Introdução teórica= | + | '''Navegação:''' [[Página principal|Mysolutions]] > [[MOOC FEX]] > PV |
| + | |||
| + | ==Introdução teórica== | ||
Aqui vamos estudar um dos fenómenos mais familiares para os alunos de secundário: a lei dos gases perfeitos. Mais espe-cíficamente, a Lei de Boyle-Mariotte, que afirma que a pressão e o volume de um gás são inversamente proporcionais. | Aqui vamos estudar um dos fenómenos mais familiares para os alunos de secundário: a lei dos gases perfeitos. Mais espe-cíficamente, a Lei de Boyle-Mariotte, que afirma que a pressão e o volume de um gás são inversamente proporcionais. | ||
| Linha 6: | Linha 8: | ||
Esta relação matemática diz-nos que num gás perfeiro (explicar o que é um gás rarefeito/perfeito?), quando diminuimos o volume, a pressão a que o gás está sujeito aumenta. Este é o princípio de funcionamento de um manómetro. | Esta relação matemática diz-nos que num gás perfeiro (explicar o que é um gás rarefeito/perfeito?), quando diminuimos o volume, a pressão a que o gás está sujeito aumenta. Este é o princípio de funcionamento de um manómetro. | ||
| − | + | (foto de um manómetro) | |
Um manómetro é instrumento que mede a pressão de gases ou líquidos (?) que estejam dentro de um recipiente fechado. Para perceber um pouco melhor o seu funcionamento, vamos fazer uma experiência em casa. | Um manómetro é instrumento que mede a pressão de gases ou líquidos (?) que estejam dentro de um recipiente fechado. Para perceber um pouco melhor o seu funcionamento, vamos fazer uma experiência em casa. | ||
| − | =A experiência em casa= | + | ==A experiência em casa== |
Os ingredientes para esta experiência são: | Os ingredientes para esta experiência são: | ||
| Linha 21: | Linha 23: | ||
| − | =A experiência no e-lab= | + | ==A experiência no e-lab== |
| − | + | [[File:montagemPV.jpg]] | |
A experiência do e-lab é semelhante à que é feita em casa, excepto que em vez de água para medir o deslovamen-to/volume, aqui usamos um sensor para medir a pressão com mais precisão. A montagem consiste num cilindro cheio de ar, cujo êmbolo é movido por um pequeno motor electrico. O par cilindro / êmbolo é implementado com uma seringa de 5cc. | A experiência do e-lab é semelhante à que é feita em casa, excepto que em vez de água para medir o deslovamen-to/volume, aqui usamos um sensor para medir a pressão com mais precisão. A montagem consiste num cilindro cheio de ar, cujo êmbolo é movido por um pequeno motor electrico. O par cilindro / êmbolo é implementado com uma seringa de 5cc. | ||
| + | [[File:controloPV.png]] | ||
| − | |||
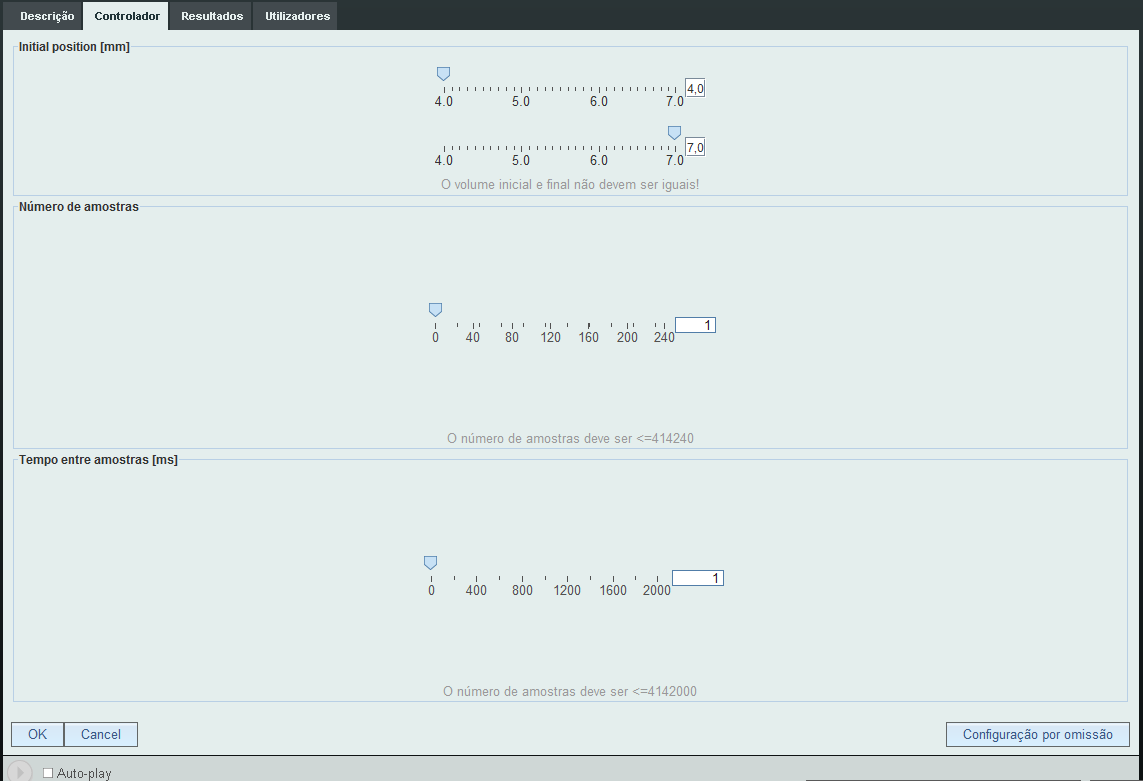
Na sala de controlo podemos escolher os volumes inicial e final. Há que notar que podemos correr a experiência como compressão ou expansão. O tempo entre aquisições permite-nos controlar o tempo da experiência. É importante prestar atenção a isto, pois o a lei em estudo só é válida para transformações adiabáticas. | Na sala de controlo podemos escolher os volumes inicial e final. Há que notar que podemos correr a experiência como compressão ou expansão. O tempo entre aquisições permite-nos controlar o tempo da experiência. É importante prestar atenção a isto, pois o a lei em estudo só é válida para transformações adiabáticas. | ||
| + | [[File:resultadosTabelaPV.png]] | ||
| − | |||
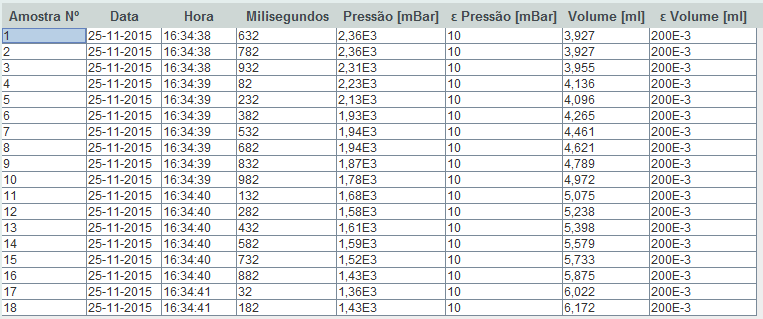
No final, obtemos uma tabela de resultados em que cada linha corresponde a uma amostra. As colunas que nos interessam são a pressão e o volume. Podemos apresenta-los graficamente: | No final, obtemos uma tabela de resultados em que cada linha corresponde a uma amostra. As colunas que nos interessam são a pressão e o volume. Podemos apresenta-los graficamente: | ||
| Linha 40: | Linha 42: | ||
(fazer o ajuste) | (fazer o ajuste) | ||
| − | |||
Para além disso, podemos também estudar a constante dos gases perfeitos. R = P*V / n*T | Para além disso, podemos também estudar a constante dos gases perfeitos. R = P*V / n*T | ||
Revisão das 16h05min de 31 de dezembro de 2015
Navegação: Mysolutions > MOOC FEX > PV
Introdução teórica
Aqui vamos estudar um dos fenómenos mais familiares para os alunos de secundário: a lei dos gases perfeitos. Mais espe-cíficamente, a Lei de Boyle-Mariotte, que afirma que a pressão e o volume de um gás são inversamente proporcionais.
PV = constante
Esta relação matemática diz-nos que num gás perfeiro (explicar o que é um gás rarefeito/perfeito?), quando diminuimos o volume, a pressão a que o gás está sujeito aumenta. Este é o princípio de funcionamento de um manómetro.
(foto de um manómetro)
Um manómetro é instrumento que mede a pressão de gases ou líquidos (?) que estejam dentro de um recipiente fechado. Para perceber um pouco melhor o seu funcionamento, vamos fazer uma experiência em casa.
A experiência em casa
Os ingredientes para esta experiência são:
- Uma seringa grande (definir tamanho)
- Um tubo transparente (loja de bricolaje?)
- Água qb
Une-se a seringa ao tubo, de maneira a que não haja fugas de interface. Enchemos o tubo com àgua de maneira a que o nível esta esteja à boca da seringa, mas não da outra ponta do tubo (o tubo deve ser fixado asimétricamente). Variando a posição do êmbolo da seringa, estamos a variar o volume do ar dentro dela. O aumento de pressão, e não esquecer que a pressão é uma força por unidade de área, vai empurar a água dentro do tudo. Sabendo a massa de água dentro do tubo podemos estimar a força que a empurra e, consequentemente, a pressão.
A experiência no e-lab
A experiência do e-lab é semelhante à que é feita em casa, excepto que em vez de água para medir o deslovamen-to/volume, aqui usamos um sensor para medir a pressão com mais precisão. A montagem consiste num cilindro cheio de ar, cujo êmbolo é movido por um pequeno motor electrico. O par cilindro / êmbolo é implementado com uma seringa de 5cc.
Na sala de controlo podemos escolher os volumes inicial e final. Há que notar que podemos correr a experiência como compressão ou expansão. O tempo entre aquisições permite-nos controlar o tempo da experiência. É importante prestar atenção a isto, pois o a lei em estudo só é válida para transformações adiabáticas.
No final, obtemos uma tabela de resultados em que cada linha corresponde a uma amostra. As colunas que nos interessam são a pressão e o volume. Podemos apresenta-los graficamente:
(Fazer o plot dos dados no excel ou no fitteia)
Podemos representar estes dados na forma de gráfico. Imediatamente vemos uma relação 1/x. Podemos fazer directamen-te o ajuste a esta função.
(fazer o ajuste)
Para além disso, podemos também estudar a constante dos gases perfeitos. R = P*V / n*T