Diferenças entre edições de "PV"
| (Há 7 revisões intermédias de 2 utilizadores que não estão a ser apresentadas) | |||
| Linha 1: | Linha 1: | ||
| − | + | '''Navegação:''' [[Página principal|Mysolutions]] > [[MOOC FEX]] > PV | |
| − | |||
| − | + | ==Introdução teórica== | |
| + | Nesta experiência vamos estudar um dos fenómenos particular da lei dos gases perfeitos: a Lei de Boyle-Mariotte, onde se constata que a pressão e o volume de um gás são inversamente proporcionais mantida a temperatura fixa, ou seja: | ||
| − | + | PV = constante = nRT | |
| − | + | Esta relação matemática diz-nos que num gás perfeiro quando diminuimos o volume, a pressão a que o gás está sujeito aumenta. | |
| − | + | Para realizar a experiência necessitaremos de construir um manómetro para determinar a pressão uma vez que o vulome pode ser determinado por uma medida direta como veremos. | |
| + | (foto de um manómetro) | ||
| − | + | Um manómetro é instrumento que mede a pressão de gases ou líquidos. Para pressões baixas e proximas da atmosfera poderemos construir um manómetro simples recorrendo a uma simples coluna de água. | |
| − | + | ==A experiência em casa== | |
| − | |||
| − | |||
| − | |||
| − | + | Os comp+onentes necessários para esta experiência são: | |
| + | * Uma seringa de 100 ml | ||
| + | * Um tubo plástico flexivel transparente com diametro interior de 4 mm | ||
| + | * Água qb | ||
| + | * Corante alimentar | ||
| + | * Fita métrica | ||
| + | * Suporte | ||
| − | + | Coloca-se o tubo numa configuração em ''U'' e enche-se a meia-altura com a água previamente misturada com um pouco de corante. Une-se a seringa ao tubo, de maneira a que não haja fugas na ligação, podendo usar-se uma cola vulgar de PVC. A seringa deve estar com o êmbolo expandido mas não no fim de escala (~90ml). | |
| − | |||
| − | + | De seguida determina-se para vários valores do volume da seringa (ex. 80 ml a 100 ml) o diferencial na altura das duas colunas de água. Deve-se varrer várias vezes o volume de modo a poder concluir sobre o erro experimental. | |
| + | O comprimento do tudo ligado à seringa com ar permite calcular o volume total de ar pela adição com o volume da seringa. | ||
| + | A diferença entre a altura do liquido permite estabelecer o valor da pressão pela fórmula: | ||
| + | |||
| + | <math>P_h= \mu gh=K \times h</math> | ||
| + | |||
| + | onde a constante K é de 9800 Pa/m ou 9,8 Pa/mm. | ||
| + | |||
| + | ''É muito importante não abraçar a seringa com a mão porque a temperatura do corpo iria afetar a temperatura do ar na seringa e a constante nRT seria definitivamente afetada.'' | ||
| + | |||
| + | O ajuste numérico deve ser efetuado com um parâmetro livre de volume (V<sub>0</sub>) para o ajuste aos erros sistemáticos nesta medida (por exemplo o volume do cone de ligação na seringa e o tubo usado na ligação). | ||
| + | |||
| + | De seguida apresentamos um gráfico do resultado obtido. | ||
| + | |||
| + | O ajuste foi efetuado com recurso ao MSExcel. | ||
| + | |||
| + | <math> | ||
| + | \begin{cases} | ||
| + | P(V)_{experimental}=9,8*(l_{h1}(V)-l_{h2}(V))+101300 | ||
| + | \\ | ||
| + | P(V)_{ajuste}=K/(V_{total}+V_0)=K/(V+l_{h1}(V) *\pi * r_{tubo}^2 + V_0) | ||
| + | \end{cases} | ||
| + | </math> | ||
| + | |||
| + | (equação de ajuste, parametros livres V<sub>0</sub> e K) | ||
| + | |||
| + | ==A experiência no e-lab== | ||
| + | |||
| + | [[File:MontagemPV.jpg|thumb|A montagem da experiência PV.]] | ||
A experiência do e-lab é semelhante à que é feita em casa, excepto que em vez de água para medir o deslovamen-to/volume, aqui usamos um sensor para medir a pressão com mais precisão. A montagem consiste num cilindro cheio de ar, cujo êmbolo é movido por um pequeno motor electrico. O par cilindro / êmbolo é implementado com uma seringa de 5cc. | A experiência do e-lab é semelhante à que é feita em casa, excepto que em vez de água para medir o deslovamen-to/volume, aqui usamos um sensor para medir a pressão com mais precisão. A montagem consiste num cilindro cheio de ar, cujo êmbolo é movido por um pequeno motor electrico. O par cilindro / êmbolo é implementado com uma seringa de 5cc. | ||
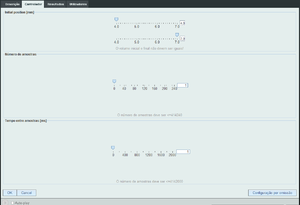
| − | + | Na sala de controlo podemos escolher os volumes inicial e final. Há que notar que podemos correr a experiência como compressão ou expansão. O tempo entre aquisições permite-nos controlar o tempo da experiência. É importante prestar atenção a isto, pois o a lei em estudo só é válida para transformações adiabáticas. | |
| − | + | [[File:ControloPV.png|thumb|Sala de controlo da experiência.]] | |
| + | |||
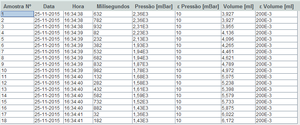
| + | No final, obtemos uma tabela de resultados em que cada linha corresponde a uma amostra. As colunas que nos interessam são a pressão e o volume. | ||
| − | + | [[File:ResultadosTabelaPV.png|thumb|Exemplo de uma tabela de resultados.]] | |
| − | + | Podemos apresenta-los graficamente: | |
(Fazer o plot dos dados no excel ou no fitteia) | (Fazer o plot dos dados no excel ou no fitteia) | ||
| Linha 40: | Linha 73: | ||
(fazer o ajuste) | (fazer o ajuste) | ||
| − | |||
Para além disso, podemos também estudar a constante dos gases perfeitos. R = P*V / n*T | Para além disso, podemos também estudar a constante dos gases perfeitos. R = P*V / n*T | ||
Edição atual desde as 11h48min de 5 de janeiro de 2016
Navegação: Mysolutions > MOOC FEX > PV
Introdução teórica
Nesta experiência vamos estudar um dos fenómenos particular da lei dos gases perfeitos: a Lei de Boyle-Mariotte, onde se constata que a pressão e o volume de um gás são inversamente proporcionais mantida a temperatura fixa, ou seja:
PV = constante = nRT
Esta relação matemática diz-nos que num gás perfeiro quando diminuimos o volume, a pressão a que o gás está sujeito aumenta.
Para realizar a experiência necessitaremos de construir um manómetro para determinar a pressão uma vez que o vulome pode ser determinado por uma medida direta como veremos.
(foto de um manómetro)
Um manómetro é instrumento que mede a pressão de gases ou líquidos. Para pressões baixas e proximas da atmosfera poderemos construir um manómetro simples recorrendo a uma simples coluna de água.
A experiência em casa
Os comp+onentes necessários para esta experiência são:
- Uma seringa de 100 ml
- Um tubo plástico flexivel transparente com diametro interior de 4 mm
- Água qb
- Corante alimentar
- Fita métrica
- Suporte
Coloca-se o tubo numa configuração em U e enche-se a meia-altura com a água previamente misturada com um pouco de corante. Une-se a seringa ao tubo, de maneira a que não haja fugas na ligação, podendo usar-se uma cola vulgar de PVC. A seringa deve estar com o êmbolo expandido mas não no fim de escala (~90ml).
De seguida determina-se para vários valores do volume da seringa (ex. 80 ml a 100 ml) o diferencial na altura das duas colunas de água. Deve-se varrer várias vezes o volume de modo a poder concluir sobre o erro experimental. O comprimento do tudo ligado à seringa com ar permite calcular o volume total de ar pela adição com o volume da seringa. A diferença entre a altura do liquido permite estabelecer o valor da pressão pela fórmula:
[math]P_h= \mu gh=K \times h[/math]
onde a constante K é de 9800 Pa/m ou 9,8 Pa/mm.
É muito importante não abraçar a seringa com a mão porque a temperatura do corpo iria afetar a temperatura do ar na seringa e a constante nRT seria definitivamente afetada.
O ajuste numérico deve ser efetuado com um parâmetro livre de volume (V0) para o ajuste aos erros sistemáticos nesta medida (por exemplo o volume do cone de ligação na seringa e o tubo usado na ligação).
De seguida apresentamos um gráfico do resultado obtido.
O ajuste foi efetuado com recurso ao MSExcel.
[math] \begin{cases} P(V)_{experimental}=9,8*(l_{h1}(V)-l_{h2}(V))+101300 \\ P(V)_{ajuste}=K/(V_{total}+V_0)=K/(V+l_{h1}(V) *\pi * r_{tubo}^2 + V_0) \end{cases} [/math]
(equação de ajuste, parametros livres V0 e K)
A experiência no e-lab
A experiência do e-lab é semelhante à que é feita em casa, excepto que em vez de água para medir o deslovamen-to/volume, aqui usamos um sensor para medir a pressão com mais precisão. A montagem consiste num cilindro cheio de ar, cujo êmbolo é movido por um pequeno motor electrico. O par cilindro / êmbolo é implementado com uma seringa de 5cc.
Na sala de controlo podemos escolher os volumes inicial e final. Há que notar que podemos correr a experiência como compressão ou expansão. O tempo entre aquisições permite-nos controlar o tempo da experiência. É importante prestar atenção a isto, pois o a lei em estudo só é válida para transformações adiabáticas.
No final, obtemos uma tabela de resultados em que cada linha corresponde a uma amostra. As colunas que nos interessam são a pressão e o volume.
Podemos apresenta-los graficamente:
(Fazer o plot dos dados no excel ou no fitteia)
Podemos representar estes dados na forma de gráfico. Imediatamente vemos uma relação 1/x. Podemos fazer directamen-te o ajuste a esta função.
(fazer o ajuste)
Para além disso, podemos também estudar a constante dos gases perfeitos. R = P*V / n*T